青岛能源所与山东大学合作揭示霉酚酸生物合成关键酶的底物多样性机制
霉酚酸(Mycophenolic Acid, MPA)及其衍生物(如吗替麦考酚酸酯、麦考酚钠等)是广泛用于器官移植和自身免疫性疾病治疗的一线免疫抑制剂药物。霉酚酸的生物合成途径具有独特的生物合成与生物降解偶联现象及复杂的区室化合成过程,其中O-甲基转移酶MpaG'在霉酚酸的合成过程中起着至关重要的作用。为了深入解析MpaG'在霉酚酸生物合成中催化功能的结构基础,青岛能源所先进生物炼制与合成研究组与山东大学酶工程研究组合作,通过解析MpaG'与多种底物的晶体结构,揭示了其在底物识别与催化中的分子机制,并提出了通过蛋白质工程改造O-甲基转移酶提高催化效率的新思路。该成果近日发表于国际期刊Protein Science上。
霉酚酸是人类历史上最早发现的抗生素,但其生物合成机制直到最近才得到较为清晰的阐明。在霉酚酸的生物合成途径中,O-甲基转移酶MpaG'作为霉酚酸生物合成中的关键酶之一,能够以较高的底物灵活性实现三种不同底物FDHMP-3C、DMMPA和FDHMP的甲基化修饰。为了阐明MpaG'的底物灵活性及其参与霉酚酸复杂合成途径中的机制,研究人员通过基因敲除和饲喂实验成功制备了上述三种底物,进而解析了MpaG'与三种底物分别形成的复合物的高分辨晶体结构,并在此基础上阐明了MpaG'的催化机制和底物灵活性机制。结果表明,MpaG'通过催化二联体H306-E362对底物的C5羟基进行去质子化,为随后的甲基化反应提供活跃状态的甲基受体。结构分析显示,MpaG'的半开放型底物结合口袋能够灵活容纳不同修饰的底物,这为其在多种底物上的高效催化提供了结构基础。三种底物的尾部结构差异较大,而MpaG'的结合口袋能够通过适应不同的尾部结构,实现对底物的灵活结合,这是MpaG'能够处理多种底物的关键所在(图1)。此外,该研究还在对催化机制和底物灵活性的深入理解的基础上进行了基于结构导向的突变实验,设计并验证了对三种底物催化效率具有明显提高的突变体MpaG'Q267A。该研究不仅扩展了对真菌天然产物生物合成中O-甲基转移酶催化机制的理解,还为O-甲基转移酶的设计和工程改造方法提供了新的见解。
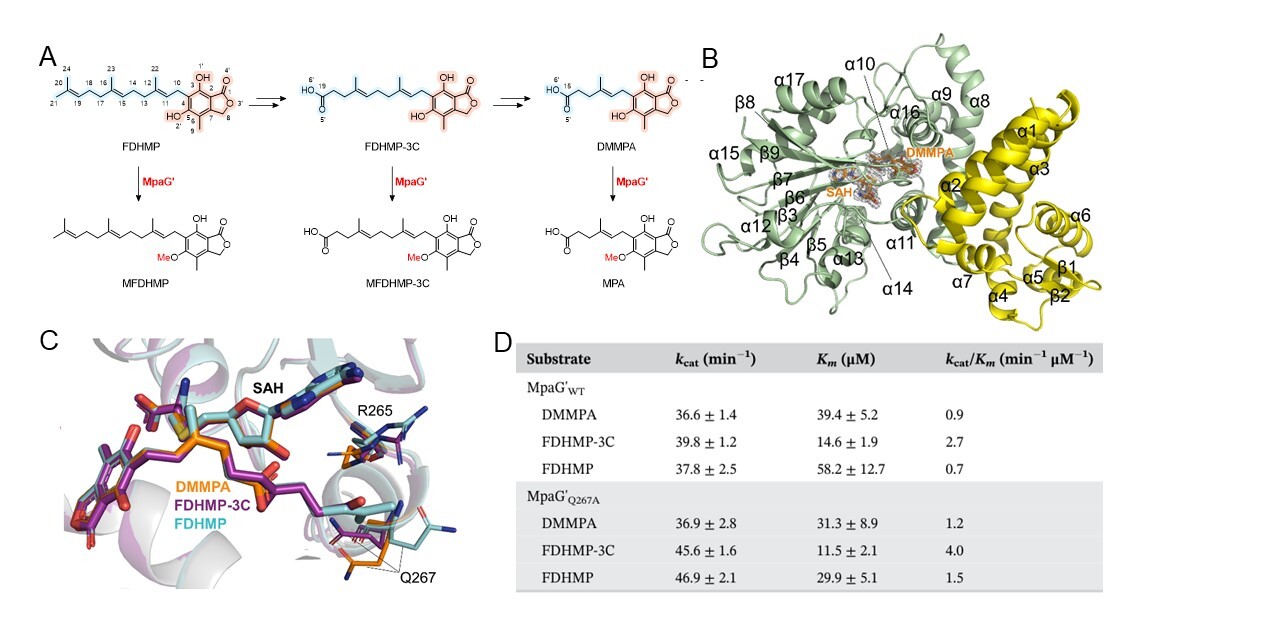
图1 霉酚酸的生物合成关键酶MpaG'的底物灵活性机制和蛋白质工程改造
该研究由先进生物炼制与合成研究组冯银刚研究员和山东大学酶工程研究组李盛英教授共同指导完成,青岛能源所助理研究员游偲和山东大学博士后潘云军为论文共同第一作者。该研究得到科技部、国家自然科学基金委、山东能源研究院和中国博士后创新人才支持计划等项目的资助。(文/游偲 图/游偲、潘云军)
原文链接:https://doi.org/10.1002/pro.5144
Cai You#,Yunjun Pan#,Ruxin Liu,Shengying Li*,Yingang Feng* (2024) Structural basis for substrate flexibility of the O-methyltransferase MpaG'involved in mycophenolic acid biosynthesis. Protein Sci. 33(9):e5144.
附件下载: