山东能源研究院/青岛能源所在P450工程酶催化不对称环氧化方面取得新进展
细胞色素P450单加氧酶是公认的多功能生物氧化催化剂,是众多天然产物生源合成途径中的限速酶之一,其也能够催化多种不同类型的烯烃环氧化反应,然而已报道的野生型P450及其工程酶在苯乙烯环氧化的(R)-对映选择性控制方面均不理想。另外,绝大多数P450单加氧酶催化功能的实现高度依赖提供还原力的辅酶NAD(P)H和负责电子传递的还原伴侣蛋白。鉴于P450酶在合成生物技术领域的巨大潜力,丛志奇研究员带领的单碳酶催化研究组近年来致力于开发不依赖于还原辅酶的非天然P450过加氧酶催化系统,在国际上首次提出“双功能小分子协同P450酶催化”的新概念,通过引入带有内嵌碱性基团的外源小分子作为助催化位点,协助P450的血红素活性中心活化过氧化氢,成功将单加氧酶P450BM3改造为以过氧化氢作为末端氧化剂的P450过加氧酶,为P450催化的非天然底物氧化转化提供了新的策略(Angew. Chem., Int. Ed. 2018, 7628, selected as Very Important Paper and Frontispiece; Chem. Eur. J. 2019, 6853, Invited Concept, selected as Review Showcase and Frontispiece; ACS Catal. 2019, 7350; Catal. Sci. Technol. 2020, 1219, selected as Inside Front Cover)。
与天然P450酶相比,“双功能小分子协同的人工P450过加氧酶”具有独特的催化特征:1)解除了P450BM3酶工程改造中对高度保守位点T268的突变限制,T268位于血红素活性中心的最近端,是天然酶中诱导催化活性中间体形成的关键残基,同时其对底物结合构象有明显调节作用,T268的可突变为催化反应的区域和立体选择性控制提供了更多的可能;2)双功能小分子N-(w-咪唑基)-己酰基-L-苯丙氨酸衍生物(N-(w-imidazolyl)-hexanoyl-L-phenylalanine, Im-C6-Phe)在发挥助催化作用的同时也可调节底物的结合构象,进而影响反应的区域和立体选择性。
在上述研究基础上,研究人员利用P450酶的半理性设计和双功能小分子协同P450催化策略有机结合,通过对T268位点作用的系统研究及与F87位点的组合突变,并结合底物空腔周围位点的迭代突变,实现了苯乙烯的高度不对称环氧化,(R)-氧化苯乙烯的对映选择性可达99% ee,催化活性同样十分优异,反应总转化数实现了目前P450过加氧酶催化苯乙烯环氧化的最优性能(图1)。取代苯乙烯的底物拓展同样呈现优异的不对称催化性能,(R)-氯/氟代氧化苯乙烯的对映选择性均可实现95% ee-99% ee。典型突变的半制备量反应可保持(R)-氧化苯乙烯的高度对映选择性,分离产率达43%以上。该研究显示蛋白质工程与双功能小分子协同P450过加氧酶催化策略组合可为酶促烯烃不对称环氧化提供一条新途径,拓展了P450酶的催化应用范围。
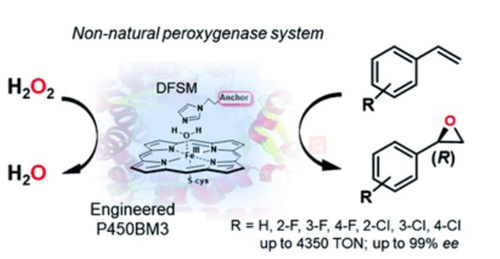
图1 双功能小分子协同P450过加氧酶催化苯乙烯不对称环氧化反应
相关工作于近日发表在英国皇家化学会(RSC)的旗舰期刊Chemical Science(影响因子:9.346)上(Chem. Sci. 2021, 12, 6307-6314),并被选为封面文章(Back Cover)。单碳酶催化研究组赵盼霞、陈杰博士为论文共同第一作者,丛志奇研究员为通讯作者。该工作得到国家自然科学基金面上项目,青岛市创新领军人才计划,青岛能源所所内合作基金以及山东省合成生物技术创新中心等的大力支持(文/图 陈杰 赵盼霞 丛志奇)。

附录:
Zhao P+, Chen J+, Ma N, Chen J, Qin X, Liu C, Yao F, Yao L, Jin L, Cong Z. Enabling highly (R)-enantioselective epoxidation of styrene by engineering unique non-natural P450 peroxygenases. Chemical Science, 2021, 12, 6307-6314.
相关链接:https://pubs.rsc.org/en/content/articlelanding/2021/sc/d1sc00317h#!divAbstract
附件下载: