双功能小分子的魔术:青岛能源所开发理性设计P450过加氧酶的新策略
细胞色素P450单加氧酶(Cytochrome P450 monooxygenase)是一类在自然界中广泛存在、以亚铁血红素为反应活性中心、以分子氧(O2)为氧化剂的多功能氧化还原酶超家族。P450酶在温和条件下高选择性地催化惰性C-H键羟化、烯烃环氧化、杂原子氧化等多种类型反应,在生物化工、有机合成等领域有着巨大的应用潜力。然而P450酶的实际应用依然存在着挑战:其利用O2的氧化还原催化过程高度依赖提供电子的辅因子NAD(P)H和输送电子的还原伴侣蛋白(reduced partner),复杂的蛋白复合物分子机器构造降低了P450酶的稳定性和催化效率。过氧化氢(H2O2)作为绿色氧化剂,在有机合成和化工上都有重要应用价值。在P450酶中使用H2O2替代O2,则不需要辅因子及其复杂的电子传递链(electron transport chains),从而可以极大简化P450酶的催化路径。然而,绝大多数天然P450酶在H2O2存在下的活性都很低甚至没有活性。
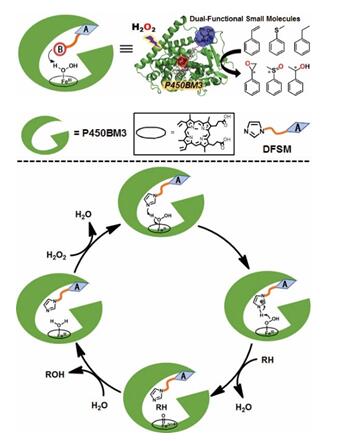
图1.双功能小分子驱动的P450过加氧酶和推测的催化机理
实际上,自然界中存在着一些可以直接利用H2O2的过氧化物酶(peroxidase)和过加氧酶(peroxygenase),它们与P450酶不同之处在于:过氧化物酶和过加氧酶的结构序列中,在活性中心近端有保守的酸碱性氨基酸残基,可以协助酶的血红素铁活性中心活化H2O2。可能正是这种天然的结构差异导致P450酶无法有效活化H2O2。针对上述难题,青岛能源所研究员丛志奇带领的单碳酶催化研究组模拟天然过加氧酶的催化机制,把化学直接干预策略与酶分子工程技术结合,将P450BM3单加氧酶成功改造为可以直接利用H2O2的P450过加氧酶(图1)。研究人员巧妙地设计了一类双功能小分子:一端的咪唑作为“催化功能基团”,另一端为带有酰基氨基酸的“锚定功能基团”。“锚定基团”通过与P450BM3的多重氢键特异识别作用把小分子固定到活性口袋,“咪唑基团”则发挥酸碱催化作用协助血红素活性中心活化H2O2。与已有报道的P450过加氧酶相比,该系统对烯烃环氧化、硫醚亚磺化、苄基型羟化等多种反应显示出更好的催化活性,为开发基于P450酶的非天然底物氧化生物催化剂提供了一条新的途径,同时为通过化学干预手段拓展P450酶的催化活性、功能、应用提供了新的思路,具有十分重要的科学意义和潜在的应用价值。相关结果已于2018年3月30日在线发表于Angew. Chem. Int. Ed.,并被选为VIP(Very Important Paper)论文,硕士生马娜娜、陈置丰、博士生陈杰为该论文的共同第一作者,丛志奇研究员为该论文的唯一通讯作者。
以上研究得到了国家自然科学基金、山东省合成生物学重点实验室、青岛能源所启动基金的大力支持。 (文/图 丛志奇 陈杰)
相关论文和专利:
1. Nana Ma, Zhifeng Chen, Jie Chen, Jingfei Chen, Cong Wang, Haifeng Zhou, Lishan Yao, Osami Shoji, Yoshihito Watanabe, Zhiqi Cong, Dual-Functional Small Molecules for Generating an Efficient Cytochrome P450BM3 Peroxygenase, Angew. Chem. Int. Ed. 2018, 57, doi: 10.1002/anie.201801592. ( https://onlinelibrary.wiley.com/doi/10.1002/anie.201801592)
2. 丛志奇,陈杰,马娜娜,陈置丰(2018)一种激活酶催化反应的双功能小分子化合物及其应用. Chinese patent. 201810126862.7.
附件下载: