青岛能源所揭示细胞原位环境对蛋白质构象动态性的影响机制
蛋白质从最初的合成、功能发挥至最后被降解,其动态性对于细胞生命的各个方面都是至关重要的。例如蛋白质的折叠、识别、别构和酶催化都与蛋白质的构象动态性有关。但是细胞内蛋白质构象动态性的研究很少,复杂的细胞环境是否影响蛋白质构象动态性是一个重要且悬而未决的问题。
近日,青岛能源所蛋白质设计研究组在细胞内原位测量蛋白质构象动态性及其机制解析方面取得重要进展。该工作证明了细胞内蛋白质与其他生物大分子的弱相互作用会抑制蛋白质环loop的构象动态性,进而可能影响蛋白质的功能。同时也强调了细胞环境对蛋白质环loop构象动态性的作用,并凸显了在细胞原位环境直接研究蛋白质性质和功能的重要性。相关成果于7月22日在线发表于Science Advances《科学进展》。
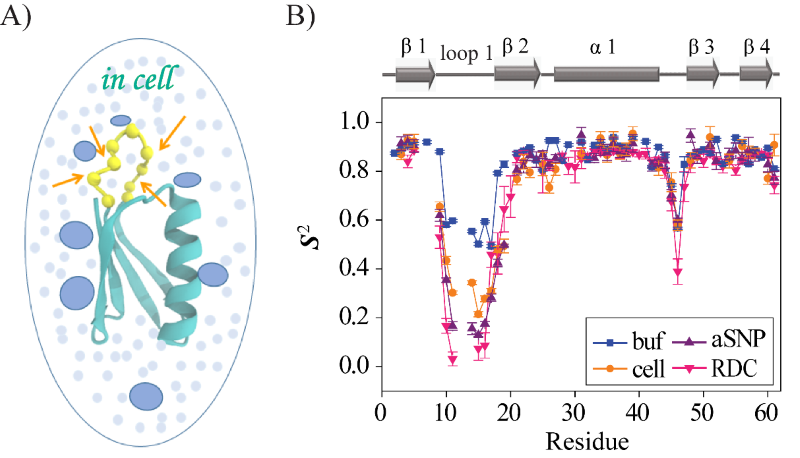
图1. 在水溶液和细胞内测量的蛋白质GB3L构象动态性的比较
该工作以大肠杆菌细胞内IgG结合蛋白质GB3L为模型蛋白质,发展了一种基于蛋白质主链15N纵向弛豫速率R2的核磁共振技术方法,利用细胞内和水溶液中蛋白质15N R2弛豫速率差异 (ΔR2) 来表征细胞内蛋白质主链的动态性(图1)。由于蛋白质GB3L和细胞内周围大分子之间的弱相互作用阻碍了蛋白质的旋转扩散,可以采用NMR自旋弛豫方法将蛋白质动态性检测时间延长至微秒,并通过纳米颗粒辅助的自旋弛豫和残余偶极耦合方法证实了蛋白质环loop1具有皮秒到微秒时间尺度的动态性。该研究进一步通过序参数 S2(0代表最柔性;1代表最刚性)表征发现,蛋白质环 loop1区域具有很强的柔性,以及α1 和β3 间的 linker也有较大的柔性(图 1B)。虽然细胞内蛋白质构象动态性与水溶液中获得的结果趋势一致,但是数值上有显著差异,更为重要的是环loop1的突变体表明,疏水和带正电荷的突变与周围大分子的相互作用变强,会让该区域在细胞内蛋白质环loop1变得更加刚性(水溶液中无相应变化),即抑制了蛋白质环 loop1区域的动态性(图 2A-B)。利用不同表面电荷特性的纳米颗粒作为大分子模型,也可以在体外重现该现象(图 2C-D)。这项工作实现了细胞内蛋白质环loop构象动态性的直接测量,为细胞环境通过弱相互作用改变蛋白质环loop的构象动态性提供了直接证据。

图2. GB3L 环loop1构象动态性与序列关系
A) 不同突变体在不同条件的序参数S 2比较;B) 细胞内环loop1 S 2的平均值与细胞环境弱相互作用的相关性;
C)和D)GB3L环loop1 (K突变体)与阴离子纳米颗粒 (aSNP)之间的静电吸引抑制了环 loop 1 的构象动态性。
该研究的第一作者是蛋白质设计研究组的博士生王梦婷和副研究员宋乡飞,通讯作者是姚礼山研究员。该工作得到国家重点研发计划项目、国家自然科学基金、山东省人才项目、中国科学院青促会项目和山东能源研究院科研创新基金等项目的支持。(文/图 宋乡飞 王梦婷 姚礼山)
附录:
原文链接:http://www.science.org/doi/10.1126/sciadv.adg9141
Mengting Wang#; Xiangfei Song#,; jingfei Chen, Xiaoxu Chen, Xueying Zhang,Ying Yang, Zhijun Liu, and Lishan Yao*, Intracellular Environment Can Change Protein Conformational Dynamics in Cells through Weak Interactions. Science Advances 2023
附件下载: