纤维小体是一类可以高效降解木质纤维素生物质的多酶复合体,在生物质能源与合成生物学中具有广泛的应用价值。产纤维小体细菌根据底物种类调控纤维小体组分的表达,从而实现对特定底物类型的高效降解。在典型的产纤维小体细菌热纤梭菌中,一类特殊的 和anti- 因子SigI-RsgI负责感应底物并调控纤维小体基因的转录。青岛能源所与生物物理所的研究人员合作,通过低温电镜技术解析了热纤梭菌的两个SigI因子和RNA聚合酶、启动子形成的转录开放复合体结构,发现SigI因子具有独特的结构域组织和启动子识别模式,进一步阐明了不同的SigI因子特异性识别启动子从而调控纤维小体组分的分子机制。该成果于2023年10月13日在线发表于Nature Communications。
细菌的 因子是基因转录过程中负责启动子识别的关键因子,大部分 因子属于 70家族,根据它们的结构和启动子识别特征被分为四个组。负责调控纤维小体表达的SigI-RsgI因子与其它 -anti- 因子的同源度较低,无法直接归属到已知的分组之中,具有独特的结构功能机制。青岛能源所代谢物组学研究组系统研究了纤维素降解热纤梭菌和它产生的纤维小体的高效作用机制,并基于热纤梭菌和纤维小体开发了具有自主知识产权的木质纤维素生物转化工艺。热纤梭菌中多对具有高度序列同源性的SigI-RsgI介导了胞外底物偶联纤维小体组分的调控,是热纤梭菌纤维小体具有高底物降解活性的关键因素之一。RsgI在没有胞外底物的情况紧密结合SigI因子并抑制其转录活性,而在感应到特定种类的胞外底物时将信号传导到胞内,并释放相应的SigI因子招募RNA聚合酶,特异性启动一组特定纤维小体基因的转录。研究组前期阐明了热纤梭菌中RsgI特异性抑制SigI因子转录活性的结构分子机制(2019 Nucleic Acids Research, https://doi.org/10.1093/nar/gkz355),揭示了RsgI的跨膜信号传导机制(2023 Science Advances, https://doi.org/10.1126/sciadv.adg4846)。为了进一步理解SigI特异性识别启动子从而启动特定纤维小体基因转录的机制,研究人员重构了包含SigI的转录开放复合体(RPo),并利用冷冻电镜单颗粒技术解析了两种不同SigI因子的RPo的近原子分辨率结构(图1)。
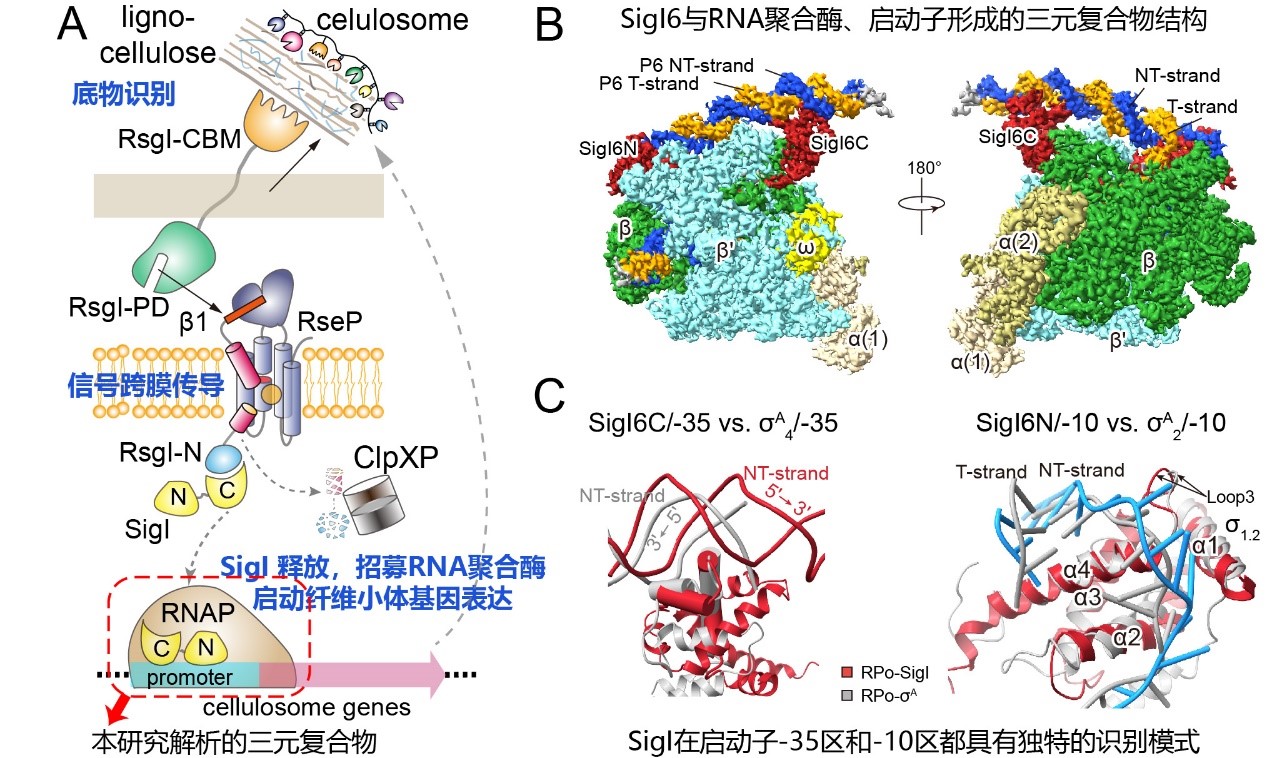
图1. 通过结构解析揭示SigI因子识别启动子的机制。(A)SigI-RsgI通过感应底物调控纤维小体转录的机制。(B)包含SigI6的转录开放复合体的冷冻电镜结构。(C)SigI6对启动子-35和-10区的识别方式。
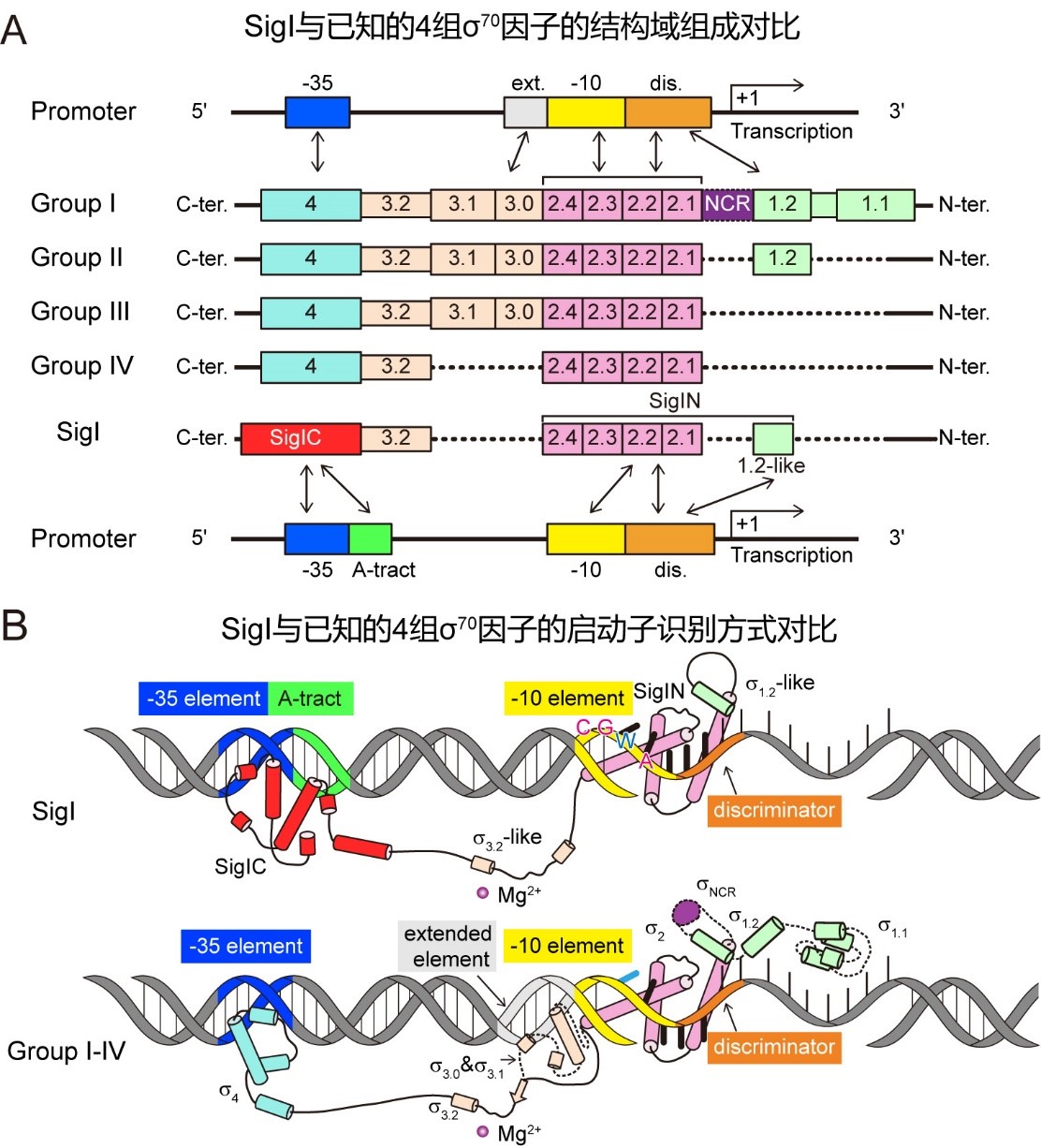
通过结构分析发现,不同于已知的 70家族成员仅结合启动子-35区域的大沟,SigI能够同时结合于启动子-35区的大沟和小沟中,小沟区域对应于SigI识别的启动子所具有的特征性A-tract区域,大沟区域对应于决定启动子特异性的关键区域。同时,相比于其他已知 70家族成员的螺旋-转角-螺旋(HTH)结构结合-35区域大沟的方式,SigI识别启动子大沟使用的HTH结构旋转了180度。在启动子-10区域,与其他已知的 70家族成员相比,SigI因子具有更多的外翻碱基和更多蛋白质-核酸相互作用。因此,SigI在启动子识别方式上与其他已知的 70完全不同,代表了一类独特的 因子类型(图2)。通过对比两个不同SigI形成的RPo复合体的结构差异,揭示了不同SigI因子的启动子识别特异性机制,并进一步通过枯草芽孢杆菌异源报告系统和体外转录系统进行了验证。该研究对细菌转录的基础分子生物学提供了新的洞察,为热纤梭菌及其纤维小体的改造与应用、基于 -anti- 因子的合成生物学开发提供了新的基础。
图2 SigI因子具有和已知的4组 70家族 因子不同的结构域组成和启动子识别方式。
该研究由青岛能源所冯银刚研究员与生物物理所朱平研究员联合指导完成,冯银刚研究员和朱平研究员为该论文的共同通讯作者,青岛能源所代谢物组学研究组博士生李颉、生物物理研究所博士生张浩楠为该论文的共同第一作者。该项研究得到组内崔球研究员和刘亚君研究员、以色列维兹曼科学研究所Edward A. Bayer教授的大力协助。中国科学院植物生理生态研究所张余研究员课题组、中国科学院天津工业生物技术研究所张大伟研究员课题组为该研究提供了重要的帮助。该研究成果得到了国家自然科学基金委、科技部、山东能源研究院、青岛市和中国科学院的资助。(文/图 冯银刚)
论文原文链接:https://doi.org/10.1038/s41467-023-41796-4
Jie Li#, Haonan Zhang#, Dongyu Li, Ya-Jun Liu, Edward A. Bayer, Qiu Cui, Yingang Feng*, Ping Zhu* (2023) Structure of the transcription open complex of distinct I factors. Nature Communications 14:6455.