细胞色素P450单加氧酶是一类以亚铁血红素为活性中心的氧化酶超家族,在生物体内广泛参与内、外源物质的合成与代谢,是极具合成应用潜力的多功能生物氧化催化剂,备受合成化学以及合成生物学等领域研究者的关注。然而细胞色素P450单加氧酶催化功能的实现依赖于辅酶NAD(P)H和还原伴侣蛋白,这限制了其在体外的催化应用。
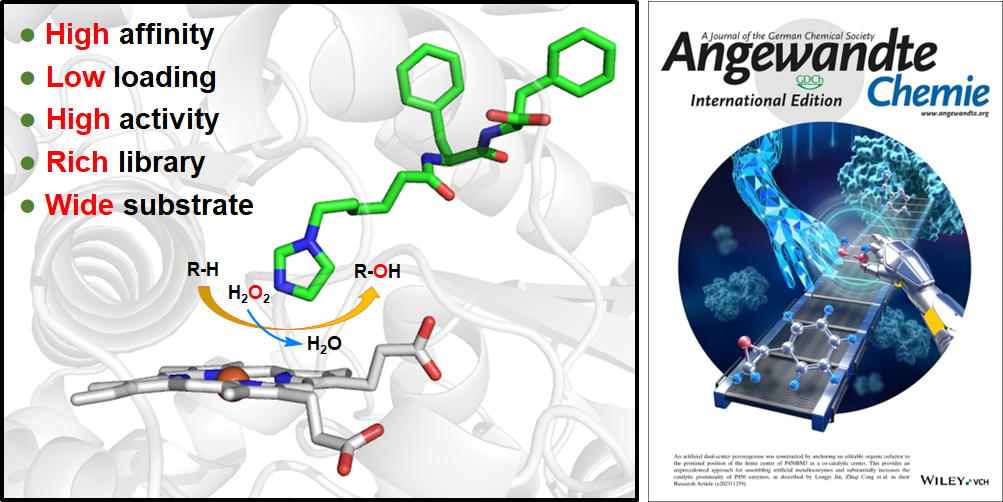
针对上述问题,丛志奇研究员带领的一碳生物技术研究中心单碳酶催化研究组模拟天然过加氧酶(peroxygenase)和过氧化物酶(peroxidase)的催化机理,设计了一类双功能小分子(Dual-functional small molecules, DFSM)——其一端以酰基氨基酸作为锚定基团、另一端以咪唑基作为催化基团——实现了P450血红素活性中心协同活化过氧化氢,从而将P450单加氧酶改造为过加氧酶模式,并结合蛋白质工程为碳-氢键选择氧化这一国际难题提供了独特解决方案[Angew. Chem. Int. Ed., 2018, 7628 (very important paper, ChemistryViews亮点研究); 2022, e202215088 (Hot paper); 2023, e202217678 & ACS Catal 2019, 7350; 2021, 8449 (Faculty Opinions推荐); 2021, 8774 & Chem. Sci. 2021, 6307 (封底, Nat. Prod. Rep.热点研究) & J. Am. Chem. Soc. 2023, 5506]。然而该过加氧酶系统的进一步实际应用仍然受到一些因素的制约,首先是DFSM对P450的极低亲和力导致催化过程中需要超过1000倍投入量;其次是催化基团仍仅限于咪唑基。
为此,研究人员通过研究典型DFSM——N-( -咪唑基)-脂肪酰基-L-苯丙氨酸(Im-C6-Phe)——与P450BM3的复合物晶体结构,受到DFSM形成双重构象的启发,设想通过由两个氨基酸缩合得到二肽作为锚定基团,可能获得具有高亲和性的人工辅助因子,从而构建双中心人工过加氧酶。研究人员从合成的73个二肽分子——N-( -咪唑基)-脂肪酰基-L-氨基酸-L-氨基酸(Im-DFSM-dipeps)——当中筛选到一系列亲和力最高提升三个数量级的DFSM,亲和性(Kd~10-8 M)已十分接近一些天然酶/辅因子,如黄素(FAD、FMN)依赖型酶。使DFSM 相对于P450BM3的负载量由1000当量降低到2当量。随后,P450BM3 F87A突变体与六个Im-DFSM-dipeps的晶体复合物解释了结合亲和力提高的原因,以Im-C6-Phe-Phe为例,它的末端羧基直接与Tyr51、Arg47、Ala72、Gln73和Ala74形成氢键,并通过水分子介导氢键网络与Leu437、Ser72和铁卟啉末端羧基作用。另外,两个苄基残基分别与由L20、Pro25、Val26、Leu29、Met185和Leu188(黄色)以及Leu17、Leu20、Phe42、Ala44和Arg47(橙色)组成的两个疏水口袋结合。强大的氢键网络和疏水作用协同将Im-C6-Phe-Phe牢固地结合在酶上,使咪唑基团与轴向配位的水分子形成氢键并与铁保持在适当的位置。其他晶体复合物均呈现相似的结合构象。最后,作者利用吡啶基和胺基取代咪唑作为酸碱催化基团合成了两个系列的新型二肽双功能分子,研究发现吡啶基DFSM和氨基DFSM均显示出与咪唑基DFSM具有不同的底物偏好性和选择性。这项研究提供了一种通过锚定可编辑的辅因子样模块作为共催化中心来构建双中心人工过加氧酶的策略,提高了P450酶的催化多功能性。
相关工作近日作为热点论文(Hot paper)和封面文章发表于国际权威期刊Angewandte Chemie International Edition《德国应用化学》。青岛能源所与延边大学联合培养博士生秦相全,以及青岛能源所姜谊平博士为论文共同第一作者,青岛能源所丛志奇研究员,延边大学金龙一教授为共同通讯作者。本研究得到国家自然科学基金、国家重点研发计划、青岛能源所强基计划项目等的大力支持(文/图 秦相全 姜谊平 丛志奇)。
原文链接:https://doi.org/10.1002/anie.202311259
https://onlinelibrary.wiley.com/doi/10.1002/anie.202315458
Qin, X.#, Jiang, Y.#, Yao, F., Chen, J., Kong, F., Zhao, P., Jin, L.,* and Cong, Z.* Anchoring a structurally editable proximal cofactor-like module to construct an artificial dual-center peroxygenase. Angew. Chem. Inte. Ed. 2023, e202311259.